La recherche
Toute personne touchée par la maladie chronique souhaite être soulagée, avoir une qualité de vie acceptable et garde en elle l’espoir d’être un jour guérie. La science et la médecine contribuent à ces objectifs.

À quoi sert la recherche ?
Les douleurs inflammatoires caractéristiques des rhumatismes inflammatoires chroniques (RIC) amènent dans un premier temps à consulter pour savoir de quoi l’on souffre. C’est la recherche qui a été effectuée en amont, et qui progresse sans cesse, qui permet au médecin d’avoir les clés nécessaires au diagnostic.
Le diagnostic étant posé, le médecin pourra prescrire des traitements développés par la recherche pour soulager les symptômes et pour ralentir voire stopper l’évolution de la maladie, en attendant qu’un jour on puisse en guérir.
La recherche ne s’arrête jamais, elle cherche en permanence à mieux connaître le fonctionnement du corps humain et les maladies qui l’affectent pour en affiner le diagnostic et pour permettre à chaque malade de bénéficier du meilleur traitement pour lui.
De la connaissance de la maladie à son traitement
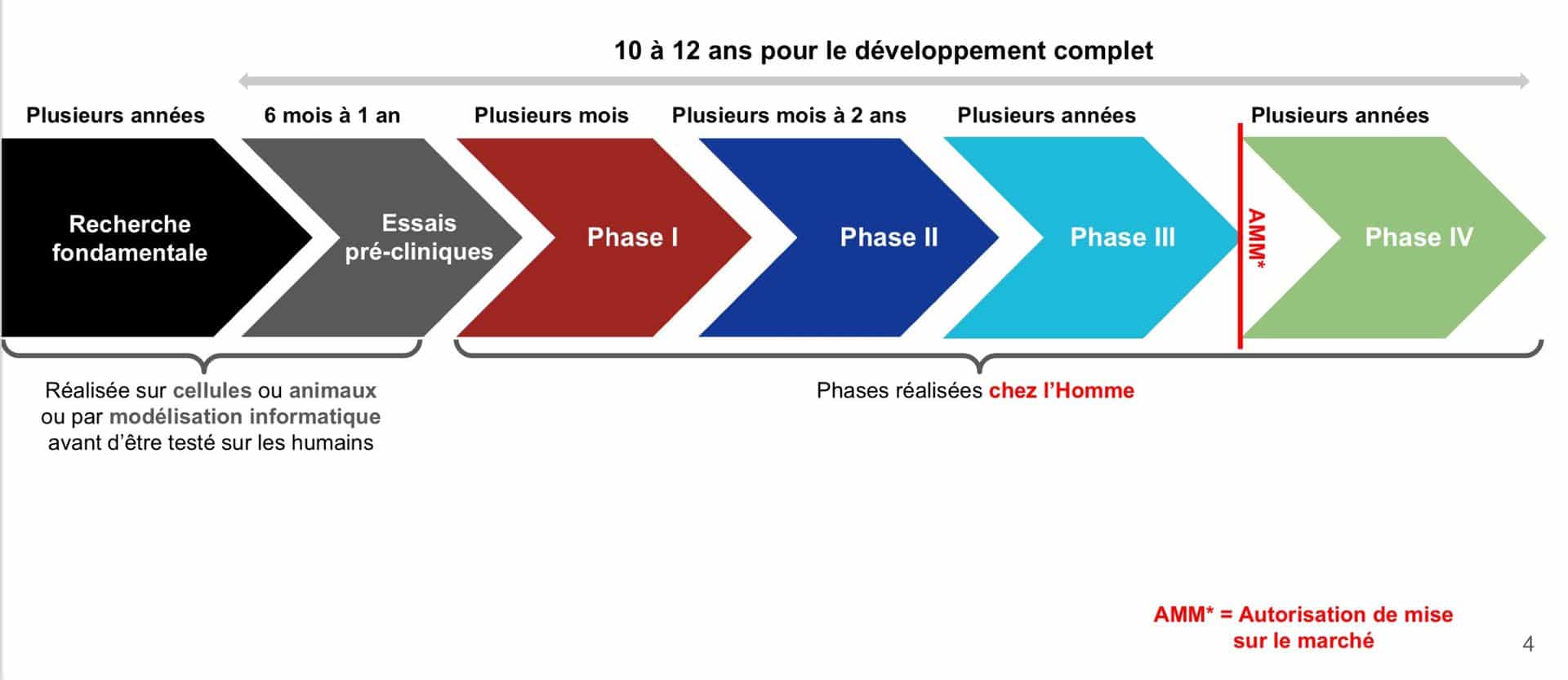
Source : Groupe Associations de patients et recherche clinique
Les traitements symptomatiques et les traitements de fond sont tous issus d’un long parcours de recherche, d’une dizaine d’années en général. Les traitements de fond sont les plus longs à mettre au point car ce sont les plus « ciblés ». Quatre grandes étapes sont nécessaires avant leur mise sur le marché :
1- La recherche fondamentale : expérimenter pour comprendre
Qui dit maladie et ses conséquences, dit besoin thérapeutique.
Partant des connaissances déjà disponibles et de leurs observations, des chercheurs du monde entier mènent des expériences sur des cellules, des animaux ou par modélisation informatique pour vérifier leurs hypothèses et résoudre des questions encore sans réponse concernant la maladie, ses causes et ses mécanismes. Parfois ils ont la réponse à leur question, parfois pas, et parfois ils ont la réponse à une question qu’ils ne s’étaient pas posée ! Dans tous les cas ils produisent du savoir permettant de mieux comprendre les mécanismes cellulaires, génétiques et immunologiques de la maladie, nécessaires à la recherche ultérieure de molécules susceptibles de répondre au besoin thérapeutique. Quand parmi elles, une molécule se dégage, elle devient molécule d’intérêt thérapeutique. L’équipe qui est à l’origine de cette piste de recherche dépose alors un brevet qui assure son exclusivité pendant 20 ans.
Le promoteur, qui a eu l’idée originelle et trouvé le financement, dirige le projet de recherche dans le cadre d’un protocole qu’il soumet pour instruction à plusieurs autorités de contrôle afin de respecter très strictement le cadre réglementaire.
2- La recherche pré-clinique : définir l’efficacité et la toxicité du candidat médicament avant son administration à l’être humain
La molécule d’intérêt thérapeutique est devenue candidat médicament. Cette étape permet d’évaluer son efficacité, sa toxicité éventuelle sur des organismes vivants (modèles cellulaires in vitro et/ou animaux) et de déterminer les modes d’administration et les doses sous lesquels il sera administré à l’être humain lors des phases suivantes.
3- Le développement clinique : évaluer la balance bénéfices-risques chez l’être humain
Les essais cliniques sur le candidat médicament démarrent si le dossier de demande d’autorisation validé par l’autorité compétente (en France, l’ANSM : Agence Nationale de Sécurité du Médicament) garantit le maximum de sécurité d’utilisation chez l’Homme. Cette étape de recherche impliquant la personne humaine (RIPH) se déroule dans un centre investigateur, souvent un établissement de santé, sous l’autorité du médecin investigateur. Elle se déroule selon trois phases à l’issue desquelles le candidat médicament deviendra médicament s’il est autorisé à être commercialisé.
Après sa mise sur le marché, les effets bénéfiques et les risques éventuels du médicament continueront à être observés, au cours d’une quatrième phase.
4- La commercialisation du médicament : les malades répondant à ses indications peuvent en bénéficier
Elle n’est possible que quand l’étape de recherche clinique est terminée et que le service rendu par le médicament est suffisant pour qu’une AMM (autorisation de mise sur le marché) soit délivrée par l’Agence Européenne du Médicament et/ou par l’ANSM et pour que son prix et son taux de remboursement soient fixés après évaluation par la HAS (Haute autorité de santé).
Les 4 phases de la recherche clinique
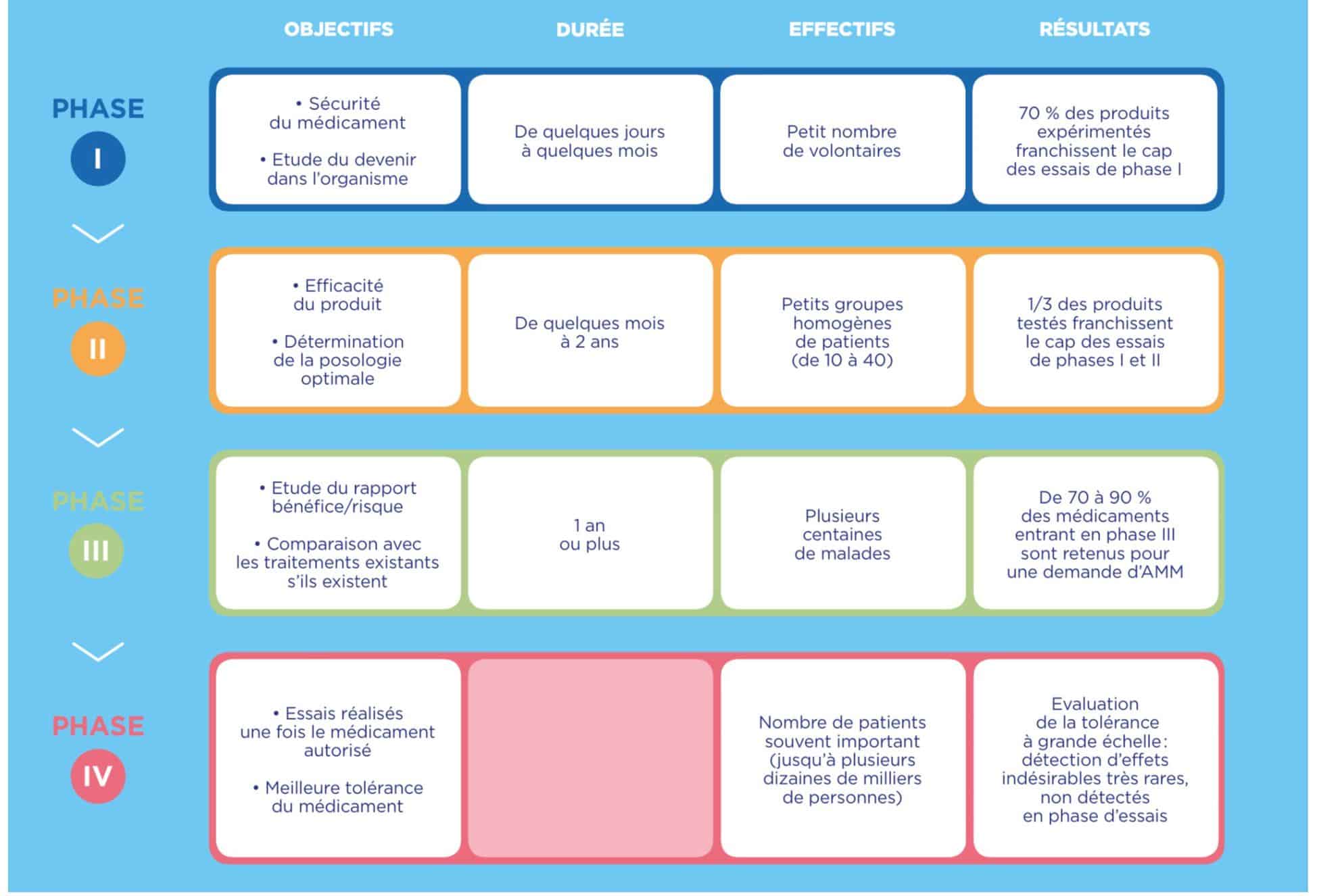
Source : LEEM
Les phases I, II et III sont dites interventionnelles : ce sont les essais cliniques, qui impliquent que l’on intervienne en modifiant la prise en charge habituelle du patient pour tester quelque chose de nouveau.
La phase IV est dite observationnelle : on observe ce qui se passe dans la « vraie vie » une fois que des patients prennent le traitement mis sur le marché.
La phase I : premiers essais cliniques chez l’être humain sain = évaluation de la toxicité
La toxicité éventuelle du candidat médicament, les effets de l’organisme sur lui (pharmacocinétique), ses effets sur l’organisme (pharmacodynamique) ainsi que la dose maximale tolérée sont évalués chez un très petit nombre de volontaires en bonne santé.
La phase II : premiers essais chez un petit groupe de volontaires atteints de la maladie concernée = évaluation de l’efficacité
L’efficacité du médicament ainsi que la dose optimale d’administration sont évaluées sur un petit groupe de malades n’ayant que la maladie ciblée par le candidat médicament. Pour cela, une comparaison est faite entre un groupe de malades recevant le candidat médicament et un groupe témoin recevant une molécule de référence déjà commercialisée pour traiter la maladie (les patients du groupe témoin ne doivent pas perdre de chances en intégrant l’essai clinique par rapport aux patients traités par des médicaments commercialisés). S’il n’existe pas de molécule de référence, le groupe témoin reçoit un placébo.
Un candidat médicament sur 5 seulement entre en phase III.
La phase III : essais chez un grand groupe de patients = étude des bénéfices et risques
L’efficacité et la tolérance du candidat médicament sont évaluées sur plusieurs centaines ou milliers de patients, toujours par comparaison avec un groupe témoin recevant un traitement de référence ou un placébo.
80 % des candidats médicaments qui passent la phase III avec succès pourront obtenir une AMM.
La phase IV : essais post-AMM en vie réelle à long terme du médicament commercialisé
Sur des milliers voire des millions de malades prenant ce traitement, sont surveillées ses conditions réelles d’utilisation (pharmacoépidémiologie) et sa sécurité d’emploi (pharmacovigilance) afin de détecter des effets indésirables rares ou des complications tardives. Les données en vie réelles sont recueillies grâce à des questionnaires auprès des patients et des médecins, ou à la déclaration d’effets indésirables éventuels.
Quelles sont les grandes voies de recherche dans les RIC ?
Dans les rhumatismes inflammatoires chroniques, la recherche a plusieurs orientations : améliorer leur diagnostic, mieux les prévenir et les traiter, et améliorer la qualité de vie des patients.
Recherche en lien avec les technologies : imagerie, numérique, intelligence artificielle…
Les progrès techniques concernant la radiologie, l’IRM, l’échographie, le PET-scan… permettent de déceler des lésions et de visualiser l’inflammation plus précocement qu’auparavant. Les progrès dans le domaine informatique et l’utilisation croissante de l’intelligence artificielle complètent de plus en plus l’expertise humaine. Ces voies de recherche en pleine explosion vont améliorer le diagnostic et la surveillance de la maladie. Elles contribuent déjà par exemple à la recherche sur la pré-PR, dont le diagnostic précoce s’appuie un faisceau d’arguments et soulève de nouvelles questions de recherche : va-t-elle systématiquement évoluer vers la PR ? faut-il traiter préventivement ? quand et comment ?
Les RIC sont en effet des maladies complexes : ils ne se déclenchent que si plusieurs facteurs sont réunis : des facteurs génétiques, immunologiques et environnementaux. La recherche est donc en général à l’interface de plusieurs domaines.
Recherche en génétique : sur les gènes de susceptibilité à un rhumatisme inflammatoire chronique
Depuis plus de 20 ans la présence de certains gènes, comme celui codant pour des peptides HLA-DRB1 dans la polyarthrite rhumatoïde (PR) et plus encore pour HLA-B27 dans la spondylarthrite (SpA), est connue comme prédisposant à la maladie.
Pourtant il ne suffit pas d’être porteur d’un gène prédisposant pour déclencher la maladie, et réciproquement tous les malades de PR ou de SpA ne sont pas porteurs de ces gènes-là.
C’est pourquoi des équipes de chercheurs continuent à explorer le rôle du génome, en travaillant par exemple sur des interactions gène/gène spécifiques de la PR ou sur les mécanismes épigénétiques (qui modifient l’expression des gènes) dans la SpA.
Sources :
- Veyssiere M., Chalabi S., Michou L., Cornélis F., Boland A., Olaso R.., Deleuze J.F., Petit-Teixeira E., Chaudru V.,
« Interactions Gène-Gène associées à la Polyarthrite Rhumatoïde dans la voie des adhérences focales »,
Revue du rhumatisme, vol. 89, 2022. - Cherqaoui B., Crémazy F., Hue C., Garchon H.-J., Breban M., Costantino F.,
« Épigénétique de la spondyloarthrite »,
Revue du Rhumatisme, vol. 88, n° 1, 2021.
Recherche en immunologie : sur le dérèglement du système immunitaire dans les rhumatismes inflammatoires chroniques
Le système immunitaire est physiologiquement destiné à lutter contre les éléments étrangers, du « non soi », qui auraient pénétré dans l’organisme. C’est un système extrêmement complexe, dont le déséquilibre participe à de nombreuses pathologies, dont les maladies auto-immunes. En découvrant ce « schéma synthétique », on peut imaginer que la recherche sur l’immunité n’en finira jamais de surprendre les chercheurs !
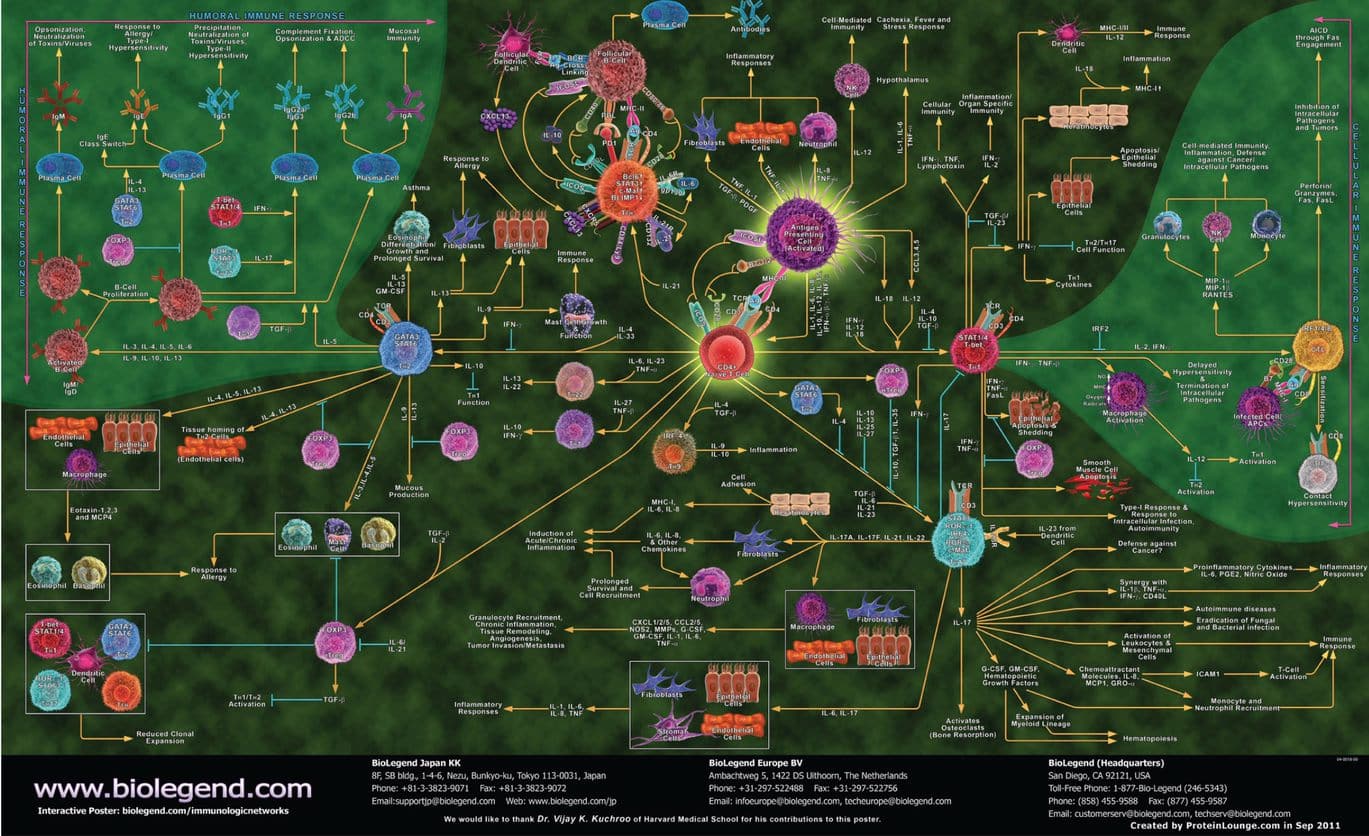
Source : BioLegend
- Dans la polyarthrite rhumatoïde (PR), l’organisme fabrique des anticorps dirigés contre des éléments du « soi ». Cette anomalie, c’est l’auto-immunité, établie dès 1937 avec la découverte des facteurs rhumatoïdes et surtout en 1999 avec celle des anticorps anti-protéines citrullinées (anti-CCP ou ACPA), qui ont révolutionné le diagnostic de la PR et orienté la compréhension de son mécanisme.
Des liens existent entre génétique et immunité. Ainsi, comprendre comment les génotypes HLA-DRB1 influencent la production d’ACPA pourrait conduire à un traitement préventif ou curatif de la PR.
Une première hypothèse est la suivante : un morceau de protéine (peptide) citrullinée nécessiterait d’être présenté par une région de la protéine HLA-DRB1 (épitope partagé) aux lymphocytes T pour que ces derniers aident les lymphocytes B à produire les auto-anticorps ACPA.
Mais qu’en est-il pour les patients qui ont une PR mais pas d’ACPA ? Une équipe française a émis une autre hypothèse : la molécule HLA ne présenterait pas au lymphocyte T le peptide citrulliné lui-même mais le transporteur qui le porte, appelé PAD4. Ce seraient d’abord des anti-PAD qui seraient produits puis, plus tard, des ACPA. De quoi avancer dans la connaissance de la maladie et orienter la recherche vers de nouvelles stratégies préventives de traitements, immuno-vaccinales, dans la pré-PR par exemple.
Les ACPA contribuent à la réaction inflammatoire principalement articulaire, qui implique également des cellules (lymphocytes T et B, macrophages, cellules dendritiques…) et des cytokines (protéines produites par des cellules pour agir sur d’autres). De nombreuses équipes travaillent sur les mécanismes de cette inflammation chronique afin de développer des médicaments qui, en freinant ou en stoppant l’inflammation, vont soulager la douleur et ralentir voire éviter les érosions articulaires, et limiter les comorbidités liées à l’inflammation d’autres organes. Les travaux effectués sur les cytokines, comme le TNF ou les interleukines, ont ouvert la voie à une recherche clinique foisonnante et à la commercialisation des biothérapies dès les années 2000. Dix ans plus tard, la place occupée par les JAK, des enzymes activées dans les cellules lorsque les cytokines pro-inflammatoires se fixent à leurs récepteurs, ont orienté la recherche vers de nouveaux médicaments : les JAK-inhibiteurs, commercialisés en France depuis 2017. Mais l’inflammation n’a sûrement pas livré tous ses secrets, et d’autres cibles thérapeutiques verront le jour, en particulier au bénéfice des patients atteints de PR “difficile à traiter” avec les traitements actuels.
- Les spondyloarthrites regroupent des formes cliniques hétérogènes, dont la spondylarthrite axiale radiographique (ankylosante) ou non, et le rhumatisme psoriasique. Elles sont classées parmi les maladies auto-immunes, bien qu’à ce jour aucun auto-anticorps n’ait encore été trouvé par les chercheurs ! Néanmoins elles semblent mettre en jeu des mécanismes inflammatoires comparables à ceux décrits dans la PR, avec le rôle très probable de la molécule HLA-B27 dans la présentation d’antigènes aux cellules immunitaires de l’inflammation. Ces mécanismes sont partiellement décrits aussi suscitent-ils toujours des travaux de recherche, dont la progression permet de personnaliser de plus en plus les traitements : les anti-TNF prescrits dans la PR le sont aussi dans les spondyloarthrites, mais les anti-IL17 prescrits que dans les SpA ne le sont pas dans la PR.
Recherche sur les facteurs environnementaux : les facteurs déclenchants de l’exposome
Quand le patrimoine génétique d’une personne comporte des gènes de susceptibilité à un rhumatisme inflammatoire chronique (RIC), qu’est-ce qui fait que la maladie va ou non se déclencher ? À cette question, le nombre d’hypothèses concernant l’exposome est extrêmement vaste, qui donne lieu à un nombre impressionnant de travaux. Il s’agit en effet de “l’ensemble des expositions à des facteurs non génétiques favorisant l’apparition de maladies chroniques, auxquelles est soumis un individu de sa conception in utero à sa mort”. La recherche s’intéresse plus précisément aux composants de l’exposome qui interagissent avec les gènes pour déclencher une maladie. Un individu est soumis à l’exposome externe qui comporte la pollution, le capital social, l’environnement, le climat, le stress… mais aussi ses habitudes alimentaires, son style de vie, son niveau d’activité physique… et l’exposome interne, dont fait partie le microbiote, c’est-à-dire l’ensemble des micro-organismes qui vivent dans le tube digestif.
Le rôle de certains facteurs de l’exposome a déjà été prouvé par la recherche, comme :
– Le fait pour une personne d’être exposée au tabac quand elle porte le gène HLA-DRB1 “épitope partagé” augmente considérablement son risque de développer une polyarthrite rhumatoïde (PR) ;
– Des bactéries de la bouche comme Porphyromonas gingivalis ou Aggregatibacter actinomycetemcomitans jouent un rôle dans la citrullination des protéines et dans la PR ;
– Un déséquilibre dans la composition du microbiote intestinal en bactéries et en champignons a été observé dans la SpA. Est-il en cause dans la maladie ? En est-il une conséquence ? Est-ce qu’en agissant sur son alimentation ou en prenant des probiotiques on pourrait prévenir ou traiter la SpA ? Voici des questions auxquelles demain nous aurons la réponse, grâce à d’ambitieux projets de recherche transversaux, qui engagent à la fois des médecins, des chercheurs en génétique, en immunologie, des scientifiques de l’environnement, des experts en nouvelles technologies, et des patients !
Recherche sur les données « en vie réelle »
Au-delà de la recherche clinique classique, les médecins accordent une importance croissante à la qualité de vie des patients. Leur objectif actuel, c’est d’atteindre la rémission, c’est-à-dire que sous traitement le patient n’ait plus de symptômes ni de marqueurs biologiques de la maladie. Leurs objectifs en tant que chercheurs seront de plus en plus souvent de répondre à ces questions : comment le patient se sent-il au quotidien avec ce traitement ? peut-on espacer ou diminuer les doses d’un traitement pour qu’il continue à se sentir soulagé tout en subissant moins d’effets indésirables de son traitement ?
Comment les malades peuvent-ils participer à la recherche ?
Les malades peuvent contribuer de différentes manières à la recherche :
- en étant membres d’une association de patients et en répondant à ses enquêtes, ils permettent à celle-ci de communiquer auprès des chercheurs sur les « vraies » priorités des malades afin d’orienter leurs projets ;
- en communiquant auprès de leur association, de leurs proches, de leur médecin quand ils ont connaissance de l’existence d’un projet de recherche, ils contribuent à l’obtention d’un échantillon statistique suffisant de participants pour que l’étude soit concluante, au bénéfice des autres malades ;
- en fournissant des données aux chercheurs :
- Ils le font au quotidien, de manière non nominative, puisque leurs données médico-administratives issues des remboursements par l’Assurance maladie intègrent automatiquement le registre du SNDS (Système national des données de santé) qui alimente la plate-forme du HDH (Health Data Hub) auxquels les chercheurs peuvent avoir accès dans un cadre très règlementé ;
- Ils peuvent intégrer un projet de recherche clinique sur proposition de leur médecin, de leur association ou après l’avoir eux-mêmes recherché sur la plate-forme européenne https://www.clinicaltrialsregister.eu ;
- Ils peuvent répondre à des questionnaires pour faire état de leurs symptômes et de leur ressenti face à la maladie, à un traitement, ou bien de leur expérience du système de soin. Le recueil de ces données (PROs = patient reported outcomes et PREMs = patient reported expérience measures) est de plus en plus plébiscité par la recherche scientifique et recommandé par les instances de santé.
- en se formant pour devenir patients-experts ou patients-partenaires, ils peuvent mieux comprendre la recherche, améliorer leur communication avec les parties prenantes des milieux de la recherche et de la santé et intégrer des groupes de travail pour porter la voix des malades à toutes les étapes des projets
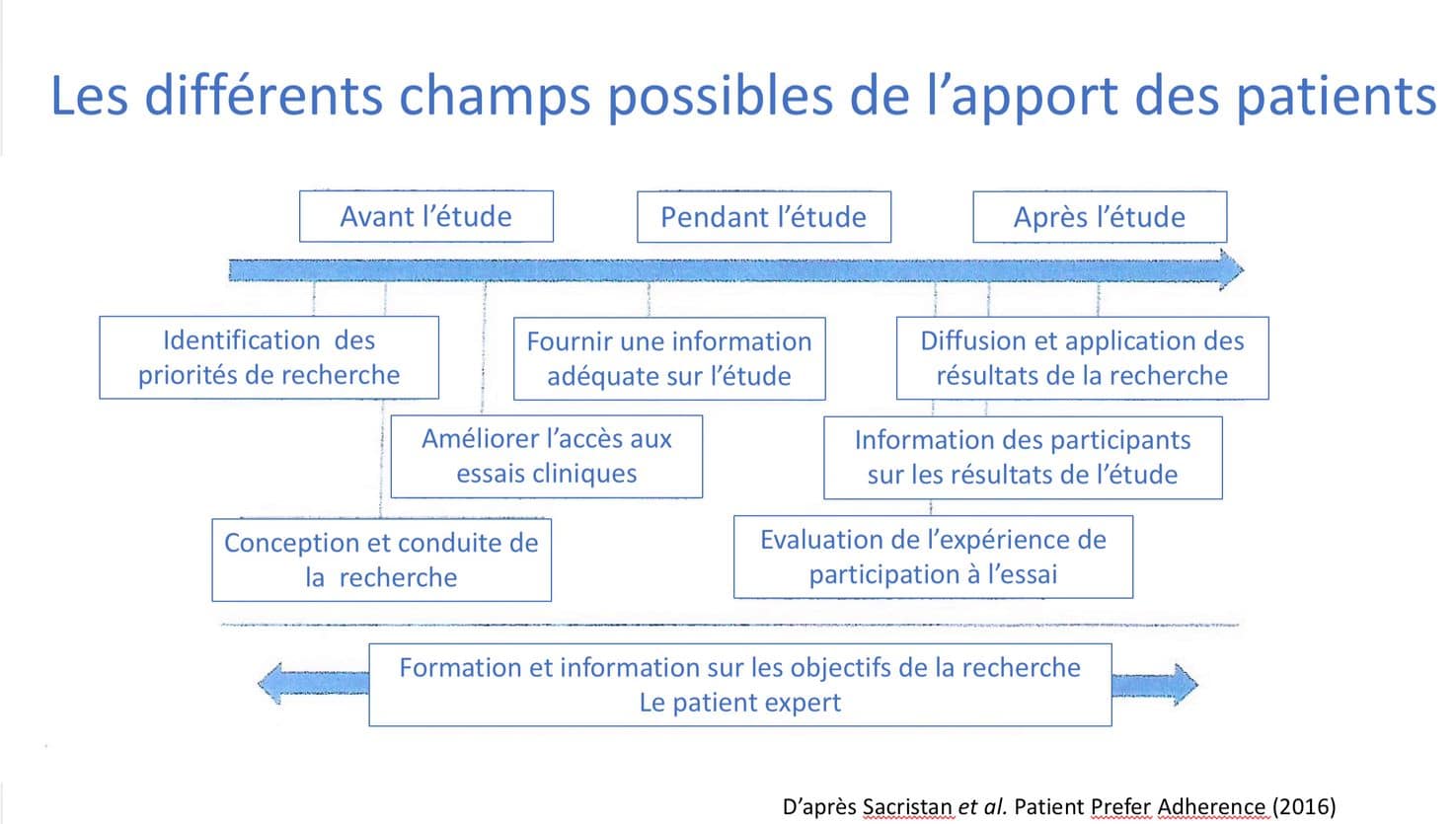
Source : Sacristan J. et al., « Patient involvement in clinical research : why, when and how », Patient Prefer Adherence, 2016.
L'avenir : la médecine personnalisée
Les progrès scientifiques, diagnostiques, thérapeutiques, technologiques, numériques et le déploiement de l’intelligence artificielle (IA) ouvrent l’ère d’une nouvelle médecine, la médecine 4P (Prédictive, Préventive, Personnalisée, Participative) et même 6P si l’on rajoute Pluriprofessionnelle voire Pluridisciplinaire et Pertinente (adaptée au patient et à un système de santé solidaire), dans laquelle le patient n’est plus seulement objet, ni même sujet de soins, mais pleinement acteur de ses propres soins et de ceux de la collectivité.

